「特医食品」在中国罕见病治疗中的应用及挑战
在此次2023年罕见病类特殊医学用途配方食品可及性报告发布会中,由上海交通大学医学院附属新华医院冯一教授讲述报告中,四星需求的罕见病FSMP使用情况调研,了解患者面临的可及性现状及主要挑战(方法:定性研究+定量研究)。根据访谈(临床治疗及临床营养科专家访谈、生产企业代表访谈)反馈出来的主要问题设计来源于患者调研问卷,共计30个省份,收到有效问卷858份
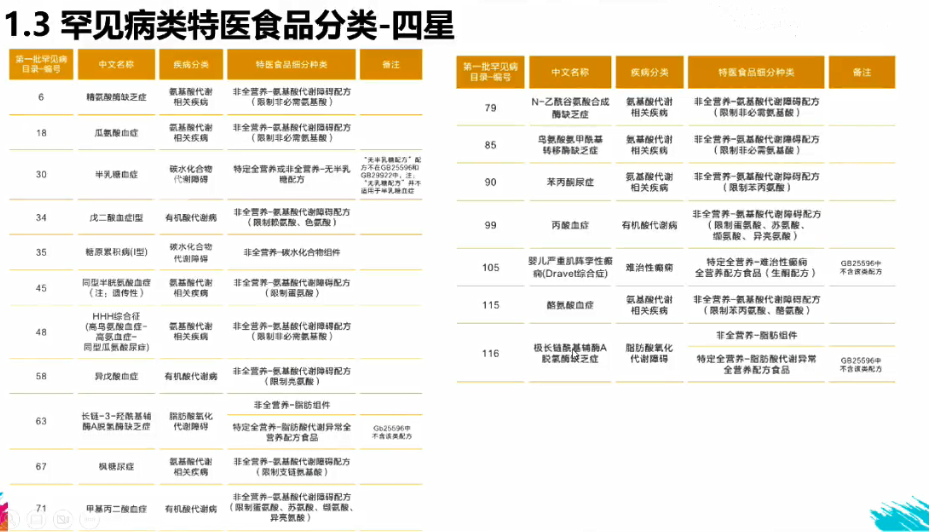
(罕见病特医食品的分类)
在调查后发现,在罕见病类FSMP在临床治疗中,使用FSMP后急诊和住院次数显著减少和略有减少,占总调查的90%,医生评估的生化指标变化,改善率94%。使用FSMP后患者评估病情进展,改善率92%。
在特医食品的购买路径中,患者对所购特殊医学用途配方食品的质量和安全有较普遍的担忧占比64.4%。
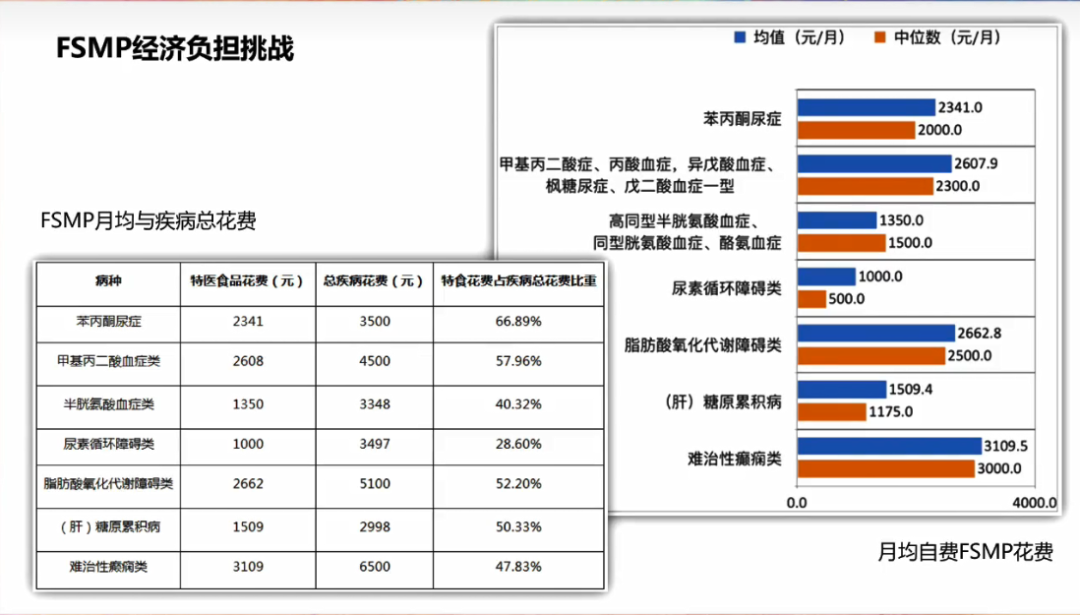
(特医食品在医疗机构中花费数据)
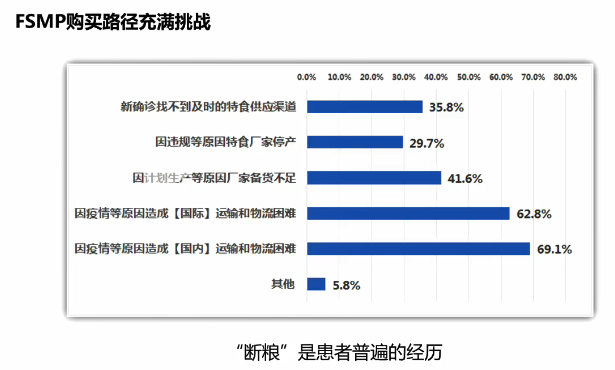
(特医食品购买路径充满挑战)
在对于临床使用特医食品中提高可及性建议:1.继续推动新生儿筛查对多种IEM(代谢病)类罕见病的覆盖。2.加强临床营养科建设,推动临床营养角色发展3.推动罕见病类FSMP分类管理,加速审评审批4.完善罕见病类FSMP供给解决方案,激励本土创新
5.推动罕见病类FSMP多方支付,缓解患者经济负担。
特医食品与罕见病
特 殊 医 学 用 途 配 方 食 品 (Foods for SpecialMedical Purpose),简称特医食品,是指为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品。根据《2023年罕见病类特殊医学用途配方食品可及性报告》,《第一批罕见病目录》中有32个罕见病需要使用特殊医学用途配方食品进行相关治疗,18种罕见病治疗过程中需及时、终生、足量使用特医食品,特医食品是此类罕见病临床治疗中的主要和核心治疗方式,如未得到及时治疗,患者将面临发育迟缓或倒退,甚至致死致残的严重后果。

(来源:《2023年罕见病类特殊医学用途配方食品可及性报告》)
特医食品的监管政策沿革
特医食品在我国的临床应用已经有几十年的历史。早在二十世纪七八十年代,我国就引入肠内营养制剂,用于治疗儿童肠道疾病。在当时,特医食品以肠内营养制剂的形式按照化学药品进行监管,需经药品注册批准后方可上市销售。这也致使一些国外产品虽然已经有很长的使用历史与良好的使用效果,但由于无法满足药物注册审批需求而无法进入中国市场。
随着我国食品安全国家标准体系的不断完善,为了满足市场需求,我国引入了发达经济体中“特殊医学用途配方食品”的概念。2010年,中华人民共和国卫生部制定了首个特殊医学用途配方食品相关标准——《特殊医学用途婴儿配方食品通则》(GB 25596—2010)。2013年,国家卫计委又制定了《特殊医学用途配方食品通则》(GB29922—2013),至此我国特医食品概念及相关标准初步建立。
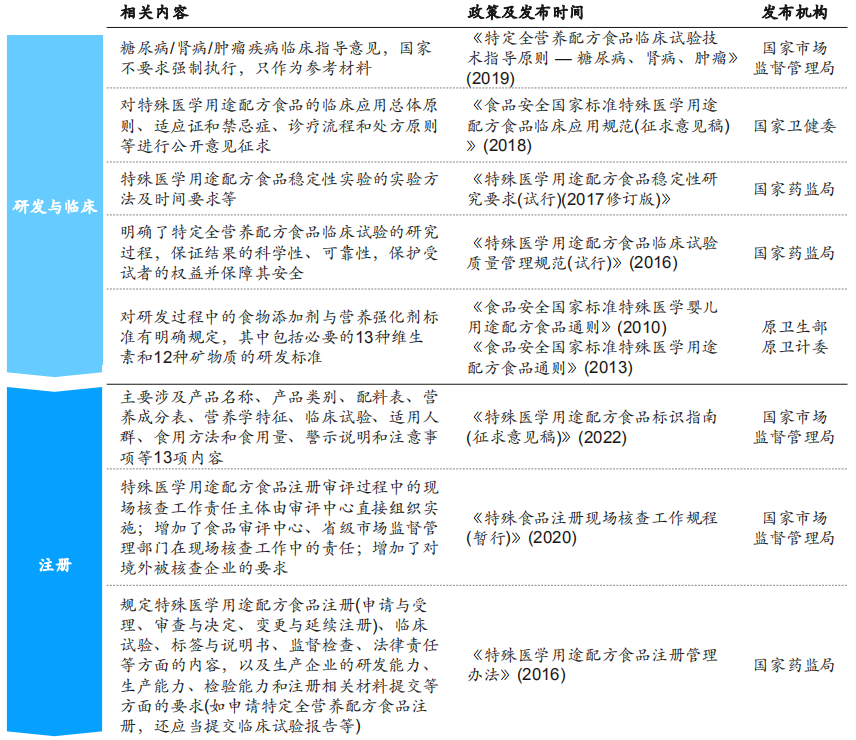
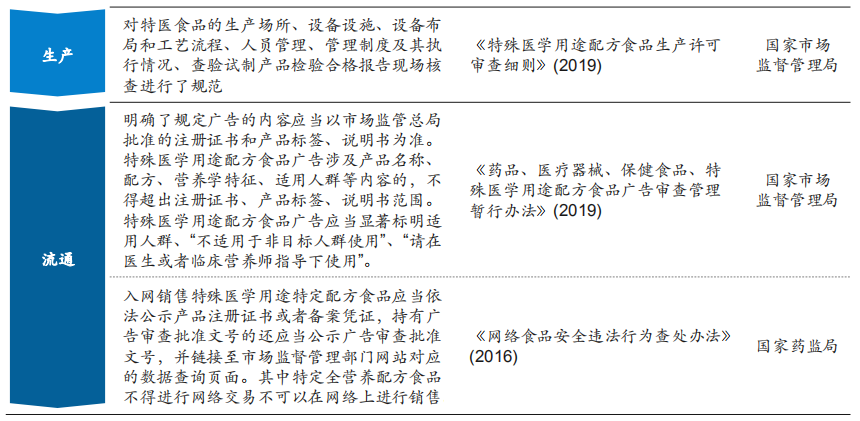
2015年《食品安全法》修订,明确指出国家对婴幼儿配方食品、保健食品和特殊医学用途配方食品等特殊食品实行严格监督管理,并从监管的角度对这三类特殊食品企业提出了要求。为进一步贯彻落实《食品安全法(2015修订)》,国家各有关部门在研发、临床、注册、生产、流通等各个环节不断出台新规政策(见图8),以进一步规范和细化特医食品的监管。
当前,特医食品在我国上市前需要进行产品注册和审批,而在美国欧盟等国家上市前无需进行注册审批(见图7)。相较于其他国家,我国对特医食品实施严格的监管要求,这对保证特医食品的安全、营养以及临床效果提供了保障,但也面临产品供给难以满足患者购买需求的挑战。我国实施特医食品注册管理制度后,截至2022年10月,共有92款特医食品获批,仅有1个罕见病病种苯丙酮尿症有3款产品获批。

罕见病类特医食品可及性的三重挑战
根据《2023年罕见病类特殊医学用途配方食品可及性报告》,对17种治疗过程中必须使用特医食品的罕见病,共855名患者的调研,92%的患者表示使用特医食品后疾病治疗进展显著或有所改善,但患者面临特医食品可及性的挑战,依次体现在可知晓、可购买、可负担三方面。
可知晓:来自诊疗的挑战
罕见病是误诊比较严重的一类疾病,比较幸运的是,需特医食品的遗传代谢类罕见病,如苯丙酮尿症、甲基丙二酸血症等可通过新生儿筛查做到早筛查早确诊。确诊后,患者需及时使用特医食品,未及时使用特医食品会带来不可逆的损伤。根据《2023年罕见病类特殊医学用途配方食品可及性报告》,新生儿筛查与患者及时使用特医食品呈正相关,医生给予清晰指引与患者及时使用特医食品呈正相关。然而,目前部分患者表示确诊时无法从医生处获得清晰的特医食品使用方案和购买方法。曾有甲基丙二酸血症患者根据医生的模糊信息到线上购物网站搜索疾病名,结果买错了产品类型。该调研还发现患者对日常饮食和营养管理在疾病重要性有非常清楚的认知,但是 认为自己对营养知识的掌握不足。目前,主要靠病友互助,患者期待更多来自专业临床营养师的指导。
•继续推动新生儿筛查在我国的人口覆盖和遗传代谢类罕见病的覆盖
•推动临床营养在罕见病治疗管理中的角色发展
可购买:患者购买需求与产品供给的挑战
我国对特医食品实施严格的监管,产品上市前需进行注册审批,市场准入门槛高,从事罕见病类特医食品生产的企业少,在我国能够买到的罕见病类特医食品的种类有限,大量患者通过非正式 渠道(如找患者群体、找代购)购买产品。一方面,受疫情影响国内国际运输困难,导致产品供应不足。根据病痛挑战基金会的调研,80.5%的患者 经历过一次或一次以上的断粮危机。另一方面, 非正式渠道购买的特医食品质量和安全难以保障。根据《2023年罕见病类特殊医学用途配方食品可及性报告》,64.4%的患者对所购买特医食品的质量和安全表示担忧,担忧主要体现在4个方面:产品配方的科学性、买到假货或劣质产品、生产过程无监管、以及运输过程造成问题。
•推动罕见病类特医食品产业监管的优化及本土研发与生产
•罕见病类特医食品中可进行分类管理,按需推进优先审评审批
可负担:患者的经济负担
根据《2023年罕见病类特殊医学用途配方食品可及性报告》,患者每个月平均花费1,000-4,000元在特医食品上,不同病种存在差异,其中苯丙酮尿症患者可一定比例报销,其他病种多为自费。这也与特医食品行业供给瓶颈有关,目前除苯丙酮尿症3款产品外,其他病种的特医食品均没有注册产品,无法进入政策性支付体系。
•推动罕见病类特医食品的注册审批及多方共付机制,缓解患者经济负担
政府主导、社会多方协同推动罕见病诊疗
政府:发布《第一批罕见病目录》,为国家制定罕见病相关政策提供重要依据
2018年5月,国家卫健委、科技部、工业与信息化部、国家药品监督管理局、国家中医药管理局五部门联合发布《第一批罕见病目录》,涵盖了 121种罕见病。罕见病目录的出台具有里程碑意义,这是中国政府首次以目录的形式界定罕见病, 为国家制定罕见病相关政策提供重要依据。2019年2月,国家卫健委发布《罕见病诊疗指南 (2019年版)》,对纳入罕见病管理的121种疾病 逐一明确诊疗方案,并依托行业组织开展医务人 员培训,提高罕见病规范化诊疗能力。随着国家持续推进罕见病相关工作,未来可能会 出台第二批、第三批罕见病目录,更新罕见病诊疗指南,更多罕见病将被纳入规范化诊疗。此前, 国家卫健委发布《罕见病目录制订工作程序》, 其中指出将分批遴选目录覆盖病种,对目录进行 动态更新,纳入目录的病种应当同时满足4个条件:1)国际国内有证据表明发病率或患病率较低;2)对患者和家庭危害较大;3)有明确诊断方法;4)有治疗或干预手段、经济可负担,或尚无有效 治疗或干预手段、但已纳入国家科研专项。
医疗系统:建立全国诊疗协作网,构建罕见病病例信息登记管理体系
2019年2月,国家卫健委遴选罕见病诊疗能力较强、诊疗病例较多的324家医院组建了罕见病诊疗协作网(见图9),对罕见病患者进行相对集中诊 疗和双向转诊,以充分发挥优质医疗资源辐射带动作用,提高我国罕见病综合诊疗能力。罕见病诊疗协作网也为罕见病患者的就医渠道提供了参 考。罕见病登记是全国罕见病诊疗协作网的重要工作内容之一。2019年10月,国家卫健委发布《中国罕见病诊疗服务信息系统工作管理方案》, 要求诊疗协作网成员医院开展罕见病病例诊疗信息登记工作,建立信息系统收集相关资料。这有利于了解我国罕见病流行病学、临床诊疗和医疗 保障现状;为制定人群干预策略、完善诊疗服务体系、提高患者医疗保障水平、提高药物可及性提供科学依据。罕见病患者容易误诊、漏诊,采用多学科诊疗模式(MDT)有助于患者尽早确诊治疗。2022年12月, 国家卫健委发布《国家罕见病医学中心设置标准》,明确了具体设置标准和要求:应具备突出的罕见病多学科协作诊疗经验,牵头编制罕见病防治指南、技术规范和相关行业标准,示范和推广罕见病先进诊疗技术,积极培养罕见病临床学科带头人和基础研究技术骨干,牵头开展罕见病防治研究,促进研究成果转化。《国家罕见病医学中心设置标准》为即将申请成立的国家罕见病医学中心进行铺垫,随着国家罕见病医学中心的成立,我国的罕见病诊疗将加速发展。
素材来源网络,如侵删

